- 定做培养基/定制培养基
- 颗粒培养基
- 标准菌株生化鉴定试剂盒
- 预灌装即用型成品培养基
- 2025年版中国药典
- 促销/特价商品
- 院感/疾控/体外诊断/采样管
- 样品采集与处理(均质)产品
- 按标准检索培养基
- 模拟灌装用培养基
- 干燥粉末培养基
- 培养基添加剂/补充剂
- 生化反应鉴定管
- 染色液等配套产品
- 对照培养基/标准品
- 实验耗材与器具
- 生化试剂/化学试剂
- 菌种鉴定服务
钴-60灭菌验证方案
山东拓普生物工程有限公司
Shandong Tuopu Biol-Engineering Co.,Ltd
VP-GC-10002
起草人: 日期:
审核人: 日期:
批准人: 日期:
目录
1概述
2目的
3验证人员
4验证进度
5验证方案内容
5.1资料档案确认
5.2设备检查确认
5.2.1安装确认与运行确认
5.3性能确认
5.3.1目的
5.3.2内包装材料材质确认
5.3.3灭菌剂量确认
5.3.4 产品装载模式的确认
5.3.5产品剂量分布图
5.3.6检测项目及标准
5.4灭菌效果测试
5.5异常情况处理程序
5.6结果确认与评价
6再验证周期
7验证总结及结果批准
7.1验证总结
7.2验证结果审查
7.3验证结果批准
1概述
辐射源发出高能量的电磁波,从而破坏细胞或者分子.继而达到杀灭细菌的目的.使用钴-60灭菌穿透力强,辐射剂量分布均匀.
2目的
确认钴-60灭菌系统能够在正常运行状态下使产品达到工艺要求,设备各项性能指标符合设计要求,保证灭菌出稳定的产品,满足产品无菌需求。根据《医疗器械生产质量管理规范》的要求,必须对钴-60灭菌效果进行验证。
3验证人员
姓名
职务
职责
4验证进度
本次验证时限为 年 月 日至 年 月 日。
5验证方案内容
5.1资料档案确认
应有如下资料:
资料名称
存放处
1. 辐射灭菌委托加工协议
2. 灭菌过程控制程序
3. 灭菌记录表
4 无菌及微生物检测记录和报告
检查结果:
设备管理员 日期: QA 日期:
5.2设备检查确认
5.2.1安装确认与运行确认
乙方根据“辐射灭菌委托加工协议”提供与本产品灭菌要求相一致的、灭菌效果稳定的设备,设备各安装与运行均达到灭菌要求。
检查项目
要 求
检查情况
设备文件
设备测试
设备校准
确认标准:应达到灭菌要求和符合《医疗器械生产质量管理规范》要求。
检查结果:
5.3性能确认
5.3.1目的:通过性能确认,证明灭菌系统能使本产品符合标准要求的无菌产品。
操作方法:在确定灭菌剂量及初始污染菌情况下,开动灭菌设备,保证各个设备的正常运行情况下,产品无菌及微生物检测指标符合《中国药典》(2010年版)无菌规定要求。
标准:按照“辐射灭菌委托加工协议”要求,灭菌设备运行正常,运转情况达到灭菌剂量,能满足本产品无菌要求。
5.3.2内包装材料材质确认
检查项目
要 求
检查情况
内包材材质
聚苯乙烯复合膜
强度
清晰度
颜色
生物相容性
包装完整性
检查结果:
检查人: 日期:
5.3.3 灭菌剂量确认
根据包材材质证明及产品无菌要求,参照GB18280-2000医疗保健产品灭菌确认和常规控制要求辐射灭菌,初始污染菌在0.1-1000范围产品适合25 KGy进行灭菌,灭菌最大剂量确定为25KGy。
5.3.3.1确定步骤1:确定产品样品:从三批样品中各抽取10个样品作为测试对象。
5.3.3.2确定步骤2:测定初始污染菌,如果使用单个样品衡量整批初始污染菌值时,值小于10则必须以10个单个样品初始污染菌值的平均值作为本批初始污染菌值。
5.3.3.3确定步骤3:按《GB18280-2000医疗保健产品灭菌确认和常规控制要求辐射灭菌》初始污染菌在0.1-1000范围产品适合25 KGy进行灭菌要求,确定最大剂量为25KGy。
5.3.3.4确定步骤4:实施验证剂量实验,将抽取的10个样品灭菌后进行单独做无菌试验,并记录实验结果阳性个数。
5.3.3.5确定步骤5:结果分析
如果 10 个无菌试验阳性个数不超过 1 个,验证剂量可以接受,证明可以 使用 25kGy 作为灭菌剂量。
如果 10 个无菌试验阳性个数为 2,则实施进一步验证实验。
如果 10 个无菌试验阳性个数多于 2 个则验证不能接受,且这一结果不能归因于初始污染菌的测定不正确,无菌实验操作不正确或验证剂量的实施不正确。
确定记录见附表1
5.3.4产品装载模式的确认
检查项目
要 求
检查情况
包装箱尺寸
56*42*32.cm
包装箱重量
包装箱内产品的方向
每个包装箱内产品的数量
灭菌剂量
最大可接受剂量
包装产品密度
0.22g/cm3
包装内单位计数
产品毛重17kg
产品传递走向
在辐照室经5个通道25个工位辐照(称为运行一圈),辐照6圈,链速1.06m/min。
电子束方位
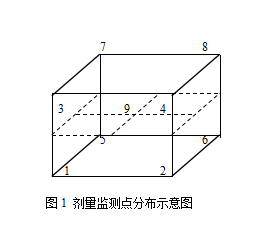
5.3.5产品剂量分布图(附后)
5.3.6检测项目及标准:
对最终灭菌产品进行测试,测试项目主要是无菌、细胞毒性指标及微生物指标。指标标准按现行《中国药典》(2010年版)和GB要求。
5.4灭菌效果测试
当系统进行正常运行结束后,测试灭菌后的产品无菌、微生物、细胞毒性,确认达到标准要求。
测试步骤:按SOP进行取样后,对最终灭菌出来的产品进行测试,测试项目主要是无菌、微生物、细胞毒性指标,
整个监测分三个批次,每个批次各项目测试一次,每次检测周期14天。
5.4.1 标准:灭菌效果应符合中国药典2010年版和GB要求
品名: 批号: 规格: 灭菌周期:
无菌
细胞毒性
微生物
无菌
细胞毒性
微生物
无菌
细胞毒性
微生物
具体内容见检验记录和报告
检查结果:
检查人: 日期:
5.4.2 灭菌后包材效果确认
品名: 批号: 规格: 灭菌周期:
项目
确认标准
确认结果
外观性能
无皱褶/重叠/裂缝、纤维脱落(开封)
热封强度
强度不小于1.5N/15mm
包装完整性
无明显贯穿热封面的溶液通道出现
品名: 批号: 规格: 灭菌周期:
项目
确认标准
确认结果
外观性能
无皱褶/重叠/裂缝、纤维脱落(开封)
热封强度
强度不小于1.5N/15mm
包装完整性
无明显贯穿热封面的溶液通道出现
品名: 批号: 规格: 灭菌周期:
项目
确认标准
确认结果
外观性能
无皱褶/重叠/裂缝、纤维脱落(开封)
热封强度
强度不小于1.5N/15mm
包装完整性
无明显贯穿热封面的溶液通道出现
检查结果:
检查人: 复核人: 日期:
5.5异常情况处理程序:在辐射灭菌系统性能确认过程中,应严格按照双方签订的“辐射灭菌委托加工协议”要求的系统标准操作程序、维护保养程序、取样程序、检验规程进行操作,按质量标准进行判定,当出现检测质量不符合标准结果时,应按“协议”要求处理后重新检测不合格项目或全项。
检查结果:
检查人: 日期:
5.6结果确认与评价:钴-60灭菌效果检验情况见附件《成品检测记录和报告》
验证结论:
负责人签名: 日 期:
6再验证周期
7验证总结及结果批准
7.1验证总结
执行人: 日期:
7.2验证结果审查
审查意见:
7.3验证结果批准
批准人: 日期:
附:产品剂量分布图