- 定做培养基/定制培养基
- 颗粒培养基
- 标准菌株生化鉴定试剂盒
- 预灌装即用型成品培养基
- 2025年版中国药典
- 促销/特价商品
- 院感/疾控/体外诊断/采样管
- 样品采集与处理(均质)产品
- 按标准检索培养基
- 模拟灌装用培养基
- 干燥粉末培养基
- 培养基添加剂/补充剂
- 生化反应鉴定管
- 染色液等配套产品
- 对照培养基/标准品
- 实验耗材与器具
- 生化试剂/化学试剂
- 菌种鉴定服务
洁净服的清洗、灭菌效果验证报告
山东拓普生物工程有限公司
Shandong Tuopu Biol-Engineering Co.,Ltd
洁净服的清洗、灭菌效果验证报告
目录
1 概述
2 验证目的
3 适用范围
4 验证小组成员与职责
5 文件资料及培训确认
6 编制依据
7 验证计划
8 确认内容
9 验证结果的分析与评价
10 验证周期
1、概述
本公司洁净区洁净服按其区域及用途使用不同颜色进行了区分,洁净服统一进行清
洗灭菌。洁净服清洗灭菌的效果直接会对洁净区的净化造成影响, 因此必须对其清洗灭菌的操作程序进行验证,确认其效果。
本验证和马来酸氯苯那敏工艺验证同时进行,每批工艺验证后的洁净服清洁后,进
行此项验证。
2、验证目的
车间洁净区洁净服在使用后,按照经批准的清洁灭菌方法操作后,能够达到清洁要求,生产时,操作人员穿着清洁后的洁净服生产产品时,没有来自上批产品所带来污染的风险。
3、验证范围
本方案适用于小容量注射剂车间洁净服的清洗、灭菌效果验证。
4、验证小组成员与职责
4.1验证小组成员
|
部门与职务 |
验证分工 |
签名 |
日期 |
|
生产副总 |
验证小组组长 |
|
|
|
小容量注射剂车间主任 |
验证小组副组长 |
|
|
|
品管部长 |
组员 |
|
|
|
QC |
组员 |
|
|
|
QA |
组员 |
|
|
|
机修工 |
组员 |
|
|
|
保洁员 |
组员 |
|
|
|
统计员 |
组员 |
|
|
4.2职责
验证小组:准备、检查和实施确认方案;设计、组织和协调验证试验;收集整理验证数据,偏差处理,编写确认报告;再验证周期的确定。
验证小组组长:组织编写验证方案,领导协调验证项目的实施,协调验证小组的工作,对验证过程的技术负责,审核批准验证方案、偏差及验证报告。
验证小组副组长:负责起草验证方案,编写验证报告,负责协调确认方案的实施,相关
操作规程的修订,协助收集整理验证数据,对偏差提出纠正措施建议。
品管部长:审核确认过程的检测数据,确认数据的可靠性,负责确认过程检验方法的确
定及安排相关检验工作,负责签发检验报告。
QA:负责验证过程中取样、监控。
QC:负责微生物项目的检测。
机修工:负责验证过程中设备的维修,确保设备运行正常。
保洁员:负责洁净服清洗、灭菌操作。
统计员:负责验证所需物料的领取工作,负责验证资料、数据收集、记录、整理。
5、文件资料及培训确认
5.1确认相关文件资料
|
序号 |
文件名称 |
编号 |
结果 |
|||
|
1 |
洁净区工作服收集、发放操作规程 |
SOP-SC-1-00600 |
□有 □无 |
|||
|
2 |
洁净区洗衣岗位操作规程 |
SOP-SC-1-00700 |
□有 □无 |
|||
|
3 |
A/B级、C级洁净工作服清洁消毒(灭菌)操作规程 |
SOP-SC-WS3-00700 |
□有 □无 |
|||
|
4 |
脉动真空灭菌柜的操作规程 |
SOP-SB-3-00300 |
□有 □无 |
|||
|
5 |
洗衣机操作规程 |
SOP-SB-1-01500 |
□有 □无 |
|||
|
6 |
脉动真空灭菌柜清洁操作规程 |
SOP-SB-WS3-00400 |
□有 □无 |
|||
|
检查人 |
|
日期 |
|
|||
5.2培训确认
在进行洁净服清洗、灭菌效果验证之前,方案起草者对所有执行本方案人员进行了培训,使每个参与方案的执行人员都理解方案内容,具备确认的前提条件。
培训结果统计表
|
培训日期 |
|
授课人 |
|
||
|
组织部门 |
|
培训地点 |
|
||
|
培训内容 |
|
||||
|
培训人员 |
岗 位 |
培训情况 |
备 注 |
||
|
组 长 |
生产副总 |
合格□ 不合格□ |
|
||
|
副组长 |
小容量注射剂车间主任 |
合格□ 不合格□ |
|
||
|
组员 |
品管部长 |
合格□ 不合格□ |
|
||
|
QA |
合格□ 不合格□ |
|
|||
|
QC |
合格□ 不合格□ |
|
|||
|
统计员 |
合格□ 不合格□ |
|
|||
|
机修工 |
合格□ 不合格□ |
|
|||
|
保洁员 |
合格□ 不合格□ |
|
|||
6、编制依据
6.1《药品生产质量管理规范》、《无菌药品附录》(2010年修订)
6.2《中国药典》2010年版二部
6.3《药品生产验证指南》(2003)
6.4《药品GMP指南》无菌药品
7、验证时间计划: 年 月 日至 年 月 日
8、验证内容
8.1洁净服清洗灭菌执行的程序
按《洁净区工作服收集、发放操作规程》、《洗衣机操作规程》、《脉动真空灭菌柜的标准操作规程》、《A/B级、C级洁净工作服清洁消毒(灭菌)操作规程》要求对洁净服清洗干燥,用脉动真空灭菌柜(每次灭菌放置18套洁净服,分上下两层,上层放置12套,下层放置6套)灭菌121℃、30min。
8.2验证方法
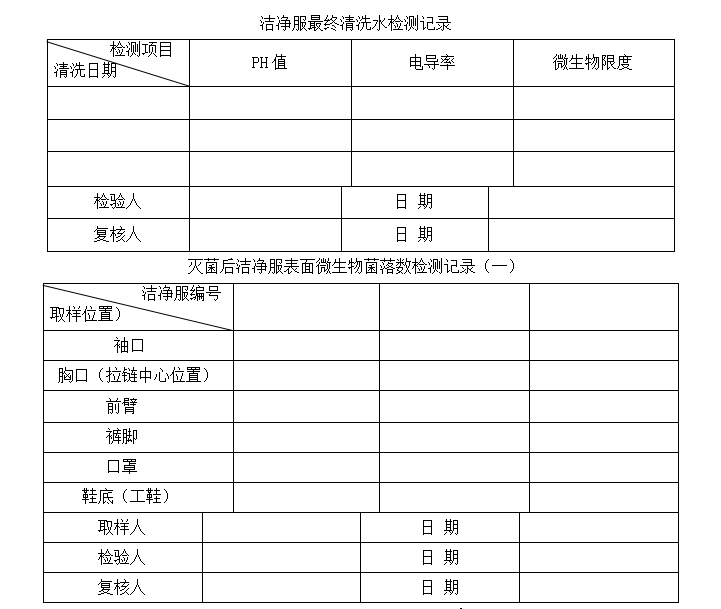
8.2.1取洁净服最终清洗水500ml进行微生物检验,准备好灭菌的营养琼脂培养皿(Φ55mm),
工作服灭菌后在指定的取样位置充分接触接触碟表面,加盖后立即放入30-35℃的培
养箱中恒温箱培养5天,计数。
8.2.2验证步骤
8.2.2.1取洁净服最终清洗水500ml进行微生物检验,连续三次。
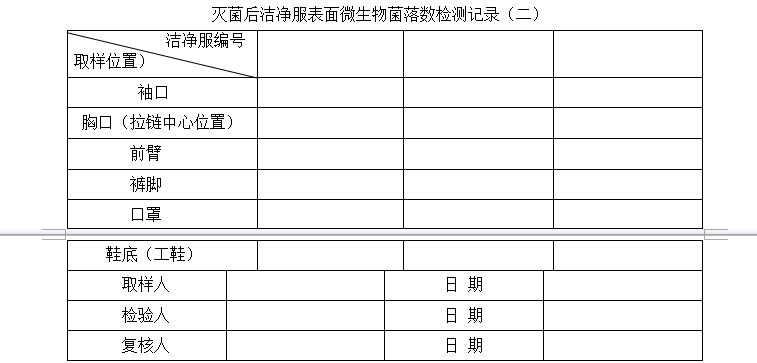
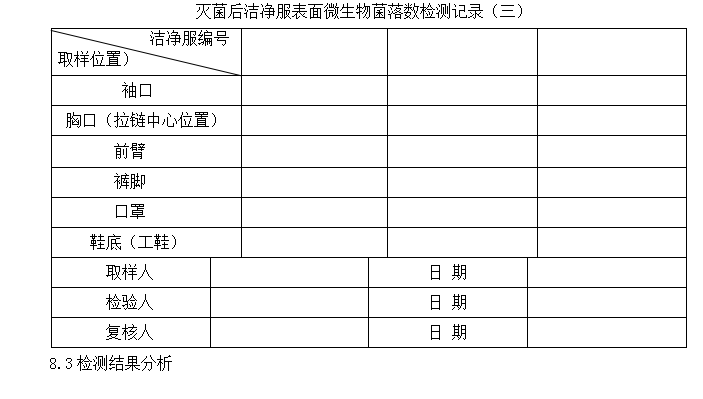
8.2.2.2灭菌后的工作服,随机抽取三套进行表面微生物的检测,连续三次。
8.2.2.3可接受的标准
8.2.2.3.1洁净服最终清洗水
PH值:5.0-7.0
电导率:<2.0μs/ cm(温度25℃)。
微生物:细菌、霉菌和酵母菌总数<100cfu/ml
8.2.2.3.2灭菌后的洁净服不得检出微生物。

评价人: 日期: 年 月 日
偏差报告
|
发生偏差的项目 |
|
偏差编码 |
|
|
偏差描述及建议的纠正措施:
制定人: 日期: 年 月 日 |
|||
|
纠正措施的审核:
审核人: 日期: 年 月 日 |
|||
|
纠正措施的批准:
批准人: 日期: 年 月 日 |
|||
|
纠正措施的效果:
确认人: 日期: 年 月 日 |
|||
9、验证结果的分析与评价
9.1验证小组负责收集各项验证、检验结果记录,起草验证报告,并报验证小组。
9.2验证领导小组负责对验证结果进行综合评审,做出验证结论,发放验证合格证,验证过程及结果的评审见下表。
验证过程及结果的评审
|
评审内容 |
评 审 |
|
验证试验是否有遗漏 |
是□ 否□ |
|
验证实施过程中对验证方案有无修改 |
有□ 无□ |
|
修改原因、依据 |
|
|
修改是否经过批准 |
|
|
验证记录是否完整 |
是□ 否□ |
|
验证试验结果是否符合标准要求 |
是□ 否□ |
|
验证结果 |
|
|
项目 |
是否符合规定 |
|
洁净服清洗、灭菌效果是否符合要求 |
符合□ 不符合□ |
|
偏差及对偏差的说明 |
|
|
是否有偏差 |
有□ 无□ |
|
偏差及对偏差的说明是否合理 |
是□ 否□ |
|
是否需要进一步补充试验 |
是□ 否□ |
|
风险分析中确定的降低风险措施的执行情况 |
执行□ 未执行□ |
|
验证结论及建议:
验证小组组长: 日期: 年 月 日 |
|
10、验证周期
11.1洁净服清洗、灭菌效果验证周期为1年。
11.2如果存在下列情形之一时,根据变更评估结果确定是否需要进行再验证。
11.2.1清洗剂或消毒剂改变,清洗、灭菌规程的修改时。
11.2.2其它任何可能影响清洗、灭菌效果的变更,如洗衣机的更换、脉动灭菌柜的改造等。
验 证 报 告
|
验证项目名称 |
|
|||
|
验证起讫日期 |
|
|||
|
验证工作部门 |
负责部门 |
|
人员 |
|
|
检验部门 |
|
人员 |
|
|
|
参加部门 |
|
人员 |
|
|
|
生产车间意见:
签名: 日期: 年 月 日 |
||||
|
工程部意见:
签名: 日期: 年 月 日 |
||||
|
品管部意见:
签名: 日期: 年 月 日 |
||||
|
验证小组组长意见:
签名: 日期: 年 月 日 |
||||
|
备 注:
|
||||



